Antes de ver propriamente disto a classificação das misturas, vamos entender alguns conceitos químicos que facilitaram o nosso estudo.
Minhas primeira pergunta é você sabe o que é um elemento químico? Elemento químico pode ser classificado como sendo um agrupamento de átomos que apresentam o mesmo número atômico. Atualmente, existem 118 elementos químicos, sendo que 92 são naturais (encontrados na natureza) e 26 são artificiais e produzidos de maneira artificial. Os elementos químicos podem ser representados por uma letra maiúscula ou por duas sendo a primeira maiúscula e a segunda minúscula.
Exemplos: H, O, He
Em um elemento químico, na tabela periódica ele pode ser representado conforme a Figura 1:
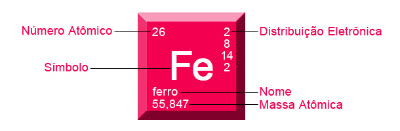
– SUBSTÂNCIAS E MISTURAS
Quando os elementos se juntam eles formam moléculas e um conjunto de moléculas forma o que conhecemos como SUBSTÂNCIAS.
As substâncias se diferem em dois tipos, de acordo com suas composições:
Substâncias simples: apresentam apenas um elemento.
Exemplos: Hidrogênio (H2), hélio (He), gás Ozônio (O3).
Substâncias compostas: são formadas por mais de um elemento químico.
Exemplos: Água (H2O), Gás cianídrico (HCN), Gás carbônico (CO2), Amônia (NH3).
As substâncias simples e compostas podem ser apresentar como Substância pura que são aquelas que apresentam apenas um tipo de molécula (é um conjunto de átomos) ou em Misturas, que são aquelas que apresentam em um conjunto de molécula diferentes juntas. Exemplificando ficaria assim:
Oxigênio (O2) – substância pura simples.
Metano (CH4) – substância pura composta.
Oxigênio (O2) + Metano (CH4) – mistura.
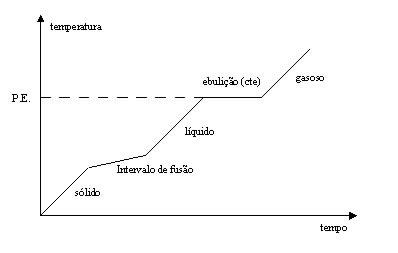
Como em uma substância pura só se tem um tipo de molécula uma de suas características é manter constante suas temperatura durante as mudanças de estado, conforme podemos observar na Figura 2.
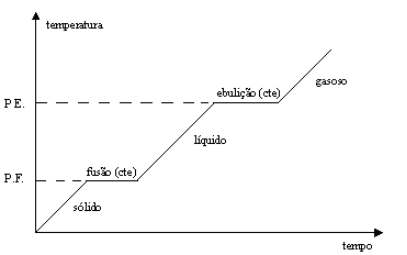
Por outro lado, as misturas que são um conjunto de moléculas diferentes, terão variações durante a mudanças de estados, conforme é mostrado na Figura 3.
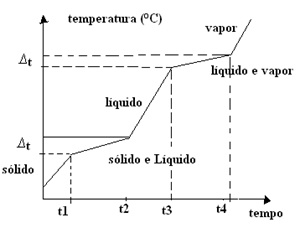
Nas misturas existem dois casos especiais que merecem ser destacados.
Existem mistura que apresentam o ponto de fusão constantes e o de ebulição variável, a essas misturas dão-se o nome de MISTURA EUTÉTICA ( Figura 4), como exemplos dessas misturas tempos a solda que é uma mistura estanho e chumbo. E existe aquelas que apresentam a temperatura de fusão variável e a de ebulição constante a essas são dados os nomes de MISTURAS AZEOTRÓPICAS, um exemplo dessa mistura é o álcool etílico e acetona.
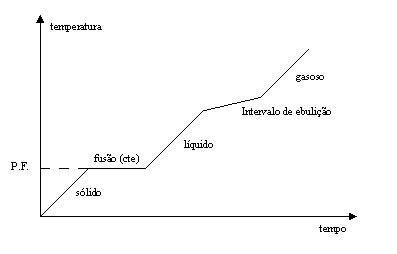
CLASSIFICAÇÃO DAS MISTURAS
Uma mistura pode apresentar diferentes fases. Mas o que é fase? Fase é quando observamos uma determinada mistura a olho nu e vemos apenas um aspeto uniforme de cada fração. Veja o exemplo na Figura 6, a mistura água e sal apresenta uma única fase (conhecido como monofásicos) e a mistura água e óleo apresenta duas fases (conhecido como bifásico).
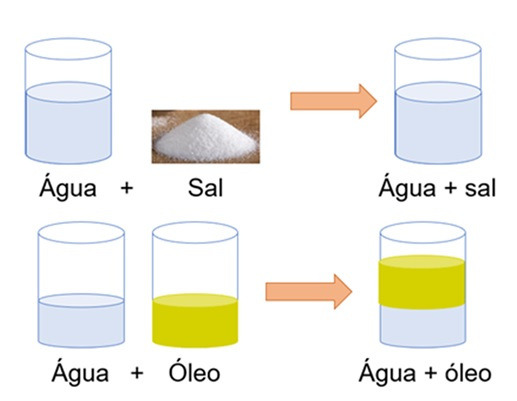
Figura 6: Representação das diferentes fases.
Observações:
• É muito importante não confundir as fases com os componentes existentes em um sistema. Observe a Figura 7.
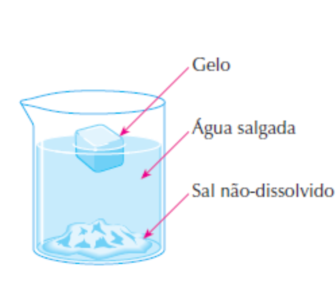
Nela temos três fases: o gelo, o sal não-dissolvido e a água líquida. E apenas dois componentes: a água (líquida ou na forma de gelo) e o sal (dissolvido ou depositado no fundo do recipiente).
• É também importante notar que uma fase pode estar subdividida em muitas porções. Se tivermos, por exemplo, um sistema formado por água líquida e cinco pedaços de gelo, teremos, mesmo assim, apenas duas fases: uma líquida (a água) e outra sólida (que é o gelo).
Devido as diferentes fases as misturas podem ser dividas em:
– Misturas homogêneas: são as que apresentam uma única fase, como mostradas a Figura 8.
Exemplo: mistura de água e álcool.

Figura 8. Mistura homogêneas.
– Misturas heterogêneas: apresentam mais de uma fase, , como mostradas a Figura 9.
Exemplo: mistura de água e óleo.


Respostas